新冠肺炎疫苗ReCOVI期临床试验阶段性数据发布免疫原性优于mRNA疫苗
日前,瑞科生物发布新冠肺炎疫苗ReCOV新西兰I期临床试验阶段性数据。
数据表明,重组双组分新冠肺炎疫苗ReCOV具有优异的免疫原性和安全性,首次接种20μg ReCOV后即可使100%的成年人受试者中和抗体呈阳性,其滴度在第2剂接种后14天时达高峰,所诱导的中和抗体滴度,与已上市的两种mRNA疫苗相当甚至更高。。
江苏省疾病预防控制中心副主任朱凤才教授表示,初步结果提示,ReCOV重组双组分蛋白疫苗可诱导与mRNA疫苗相似或更高水平的中和抗体,预示ReCOV可对SARS—CoV—2感染引起的疾病具有良好的预防效果。
I期临床试验ReCOV安全性和免疫原性表现突出
ReCOV疫苗由江苏省疾病预防控制中心,泰州医药高新技术产业园区和瑞科生物联合研发,其采用中和抗体指导的基于抗原靶标的全新疫苗设计理念,在对新型冠状病毒S蛋白两个关键结构域RBD和NTD与其对应的全人源中和抗体FC08,FC05的结合位点,作用机制等进行深入剖析之后,提出了中和抗体Cocktail理念,设计了针对S蛋白RBD和NTD双组分亚单位新冠病毒下一代基因工程疫苗的概念并完成功能性验证。
2021年6月,瑞科生物启动ReCOV疫苗在新西兰I期临床试验,这也是我国自主研发的新冠疫苗首次在发达国家开展临床试验。
朱凤才教授表示,接种剂量20μg共两剂ReCOV疫苗后,中和抗体水平数据超过预期,根据澳大利亚360biolabs实验室分析的数据,中和抗体水平达到1643.2 IU/mL,而公开资料显示两种mRNA疫苗——Moderna疫苗和Pfizer疫苗,接种后的中和抗体水平分别为1404.16 IU/mL和928.75 IU/mL。
新冠疫苗ReCOV采用了独特的抗原结构设计与新型佐剂
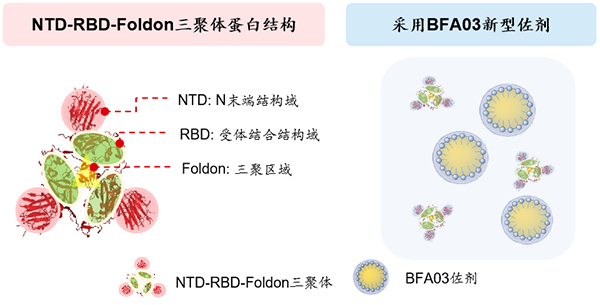
朱凤才教授特别指出,新冠中和抗体是评价新冠疫苗保护效力的最重要指标,通过采用世界卫生组织推荐的康复者血清标准品进行标定,可用国际单位对不同疫苗进行科学的横向比较。
安全性与耐受性上,ReCOV新西兰I期临床试验阶段性数据显示,高,低剂量组ReCOV在成年及老年受试者均未报告SAE或导致提前退出研究的TEAEs,未报告有临床意义的生命体征或临床实验室检查异常常见不良反应与上市疫苗相似,绝大多数为轻度并已痊愈
进行此次ReCOV新西兰I期临床试验阶段性数据检测的中心实验室360biolabs,是澳大利亚和新西兰地区领先的综合性专业实验室,通过了 ISO/ IEC 17025, ISO/ IEC 15189 和 OECD GLP 等质量体系和国际认证朱凤才教授表示:疫苗临床试验在发达国家的评价体系是非常复杂的,从ReCOV疫苗的临床研究情况来讲,除中和抗体外,还进行了细胞免疫的研究,数据也非常不错这次选在新西兰开展临床试验,就是看中了其国际化标准的临床规范,检测能力和数据分析能力,其分析方法验证和报告符合 ICH,FDA和EMA的要求
多重优势为ReCOV全球大规模推广奠定基础
受制于疫苗储存和生产等因素,全球尚有近半数人群未接种新冠疫苗,在低收入国家的新冠疫苗覆盖率仅为2%,全球对安全,优效,可及性好的新冠疫苗仍有紧迫的需求瑞科生物董事长兼总经理刘勇博士表示
朱凤才教授认为,就新冠疫情来讲,如果能够用更有效的疫苗更好地控制疫情,那治疗药物起到的作用就是查漏补缺,救助少数患者,而不是起决定作用预计新冠病毒短时间内不会消失,也可能长期存在,因此对疫苗的需求是不容置疑的
根据瑞科生物正在进行的稳定性研究显示,ReCOV可在室温下保持稳定至少6个月,而在标准冷链条件下预期可保持稳定至少24个月这一特点使ReCOV适合在气候炎热而冷链物流及基础设施有限的发展中国家及地区大规模接种而其高产率,产能可快速扩展,知识产权和供应链完全自主等优势为ReCOV在全球大规模推广奠定了产能和成本优势
瑞科生物表示,将会尽快启动涉及全球多个国家的后续大规模临床试验以进一步评估ReCOV的有效性与安全性,公司计划于2022年2季度或3季度提交EUA或附条件上市申请。10月11日晚,沃森生物发布公告称,公司及子公司玉溪沃森生物科技有限公司自主研发的ACYW135脑膜炎球菌多糖结合疫苗近日收到广西伦理审查委员会出具的开展三期临床试验的伦理审查意见,标志着该疫苗已进入三期临床试验。
按照瑞科生物的规划,其自有生产设施预计将于2021年末前投入商业生产,实现年产1亿剂产能,未来可快速扩产至年产3亿剂通过与CDMO企业的产能合作,到明年下半年,ReCOV疫苗的产能可逐步满足全球需求
。郑重声明:此文内容为本网站转载企业宣传资讯,目的在于传播更多信息,与本站立场无关。仅供读者参考,并请自行核实相关内容。