5天1万美金!有款新冠特效药来自中国就是有点贵
15个国家获得紧急使用授权,全球订单超过100万剂,挽救上万人的生命。

这项成绩,来自中国药企参与的一种双抗体疗法。
据统计,截至12月5日,已有超过70万名患者接受了双抗体疗法或巴尼韦单抗治疗,在疫情最严重时期,潜在防止超过3.5万例住院和至少1.4万例死亡发生。
最近几天,君实生物发布公告,FDA扩大了这种双抗体疗法的紧急使用授权范围,首度将适用人群覆盖到12岁以下,可为全年龄段的高风险人群提供治疗和预防新冠肺炎。
它是当下治疗新冠重症最有效的药品之一,现在普及的最大挑战,就是有点贵!
非常时期的灵药
这一双抗体疗法,由新冠中和抗体药物JS016与另一款抗体巴尼韦单抗联合形成。
其中,JS016是一款重组全人源抗SARS—CoV—12单克隆中和抗体,由中国药企君实生物与中国科学院微生物研究所共同开发。
人类的血浆中大约有数千万至上亿种抗体,所谓中和抗体,是经过人为筛选和制备的抗体药物,成分单一,特异性高,安全性好,可精准靶向新冠病毒的抗原位点,是一种良好的治疗和预防手段。
非常时期,非常速度从研发到紧急使用授权,JS016仅用了1年的时间
2020年2月,严景华团队与中国科学院院士高福团队合作,筛选出了具有高效中和活性的抗体药物,3月就交由君实生物产业化研发中国的临床试验,由复旦大学附属华山医院张文宏教授主持
就在5月,礼来制药以最高 2.55 亿美元的价格获得海外权益。
2021年2月,因能显著降低住院率和死亡率,由JS016与礼来制药另一款抗体巴尼韦单抗形成的双抗体疗法,就获得FDA紧急使用授权,用于治疗伴有进展为重症以及有住院风险轻中度COVID—19患者,但是,年龄限制在12岁以上。
从研发到紧急使用授权,JS016仅用了1年的时间。
双抗体疗法在德尔塔变异毒株中仍然保持活性,9月,该疗法获得FDA紧急使用授权,用于12岁及以上高风险人群的暴露后预防以防止新型冠状病毒感染。
也就是说,预防和治疗,这项双抗体疗法皆可用。
美国政府追加采购了3.3亿美元的38.8万剂JS016紧接着,欧盟也宣布采购22万剂的双抗法疗法用药
最新扩大的紧急使用授权范围,则是将12岁以下所有年龄段进行了覆盖。
根据临床试验的每日症状记录,对于接受埃特司韦单抗1400毫克及巴尼韦单抗700毫克双抗体疗法的受试者,其症状完全缓解的中位时间为7天,对于基于体重给药的受试者,其症状完全缓解的中位时间为5天,无儿科受试者因COVID—19死亡或住院。
百亿美金的商机
诸多治疗新冠的药物中,最受热捧的就是中和抗体,有人将之视作真正的特效药。
目前,全球有超过20款中和抗体获批临床,3款已获FDA/EUA紧急授权使用,包括再生元/罗氏的REGN—COV2以及Vir/GSK的Sotrovimab。
据兴业证券预测,到2021年末,中和抗体的商业化市场空间可达 68.7—146.4 亿美元,但是集中在欧美发达国家市场,其市场空间将达 54.3—110.4 亿美元。
这对医药公司是一次难得商机。
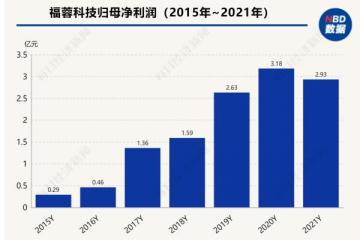
以君实生物为例,双抗体疗法紧急使用授权范围的加大与采购放量,是其今年业绩增长的新动力。
礼来中报显示,2021年上半年,JS016在内的新冠中和抗体总销售额达9.59亿美元,据披露,JS016产品的销售分成将是净额两位数百分比,也有外界预测是1:1分成。
君实生物方透露,截至今年3月,JS016销售收入超过11亿元,在一季度,其公司营收达到16.15亿元,净利润3.77亿元,也首度实现盈利。
JS016/etesevimab的授权范围扩大,将有助于其进一步提升业绩。
目前,国内的新冠中和抗体进展也在加速。
腾盛博药最近几天临床揭盲,称使住院和死亡复合终点降低80%,体外嵌合病毒实验数据表明,该疗法对主要新冠病毒变异株均保持中和活性,目前正对奥密克戎变异株进行检测。
不过,单就现有的中和抗体而言,价格仍然过高,阻碍了在低收入国家的普及。
目前的单剂价格超过2000美金,一个疗程的治疗费用,大概在1万美金左右,平均到每天大概在1.3万元人民币左右。
兴业证券预测,中和抗体的场景,将更多集中患者治疗因为价格高,预防时间短等劣势,在高风险人群预防方面,很容易被疫苗替代,市场规模较小,或将不超过10 亿美元
。郑重声明:此文内容为本网站转载企业宣传资讯,目的在于传播更多信息,与本站立场无关。仅供读者参考,并请自行核实相关内容。